与您一起解读:全球新冠肺炎疫情严峻形势下不同类型疫苗研究进展分析
文章来源:AVT发布时间:2020-04-03浏览次数:
文章来源于火石创造 ,作者张新,杨周宁
疫情还在持续中,艾伟拓作为原辅料供应商,时刻关注着疫苗研究情况!本期与您一起解读:全球新冠肺炎疫情严峻形势下不同类型疫苗研究进展分析。
背景
当前,新冠疫情在国内外呈现不同的发展趋势。一方面,国内在疫情发生后果断的管控措施,使得国内疫情得到了有效的控制,进入疫情防控的新阶段;另一方面,国外在我国进行防疫管控时,由于没有采取积ji的应对措施,错失了我国为世界争取的宝贵时间,使得多国相继沦陷为疫情重灾区,国外感染人数已远超过国内。
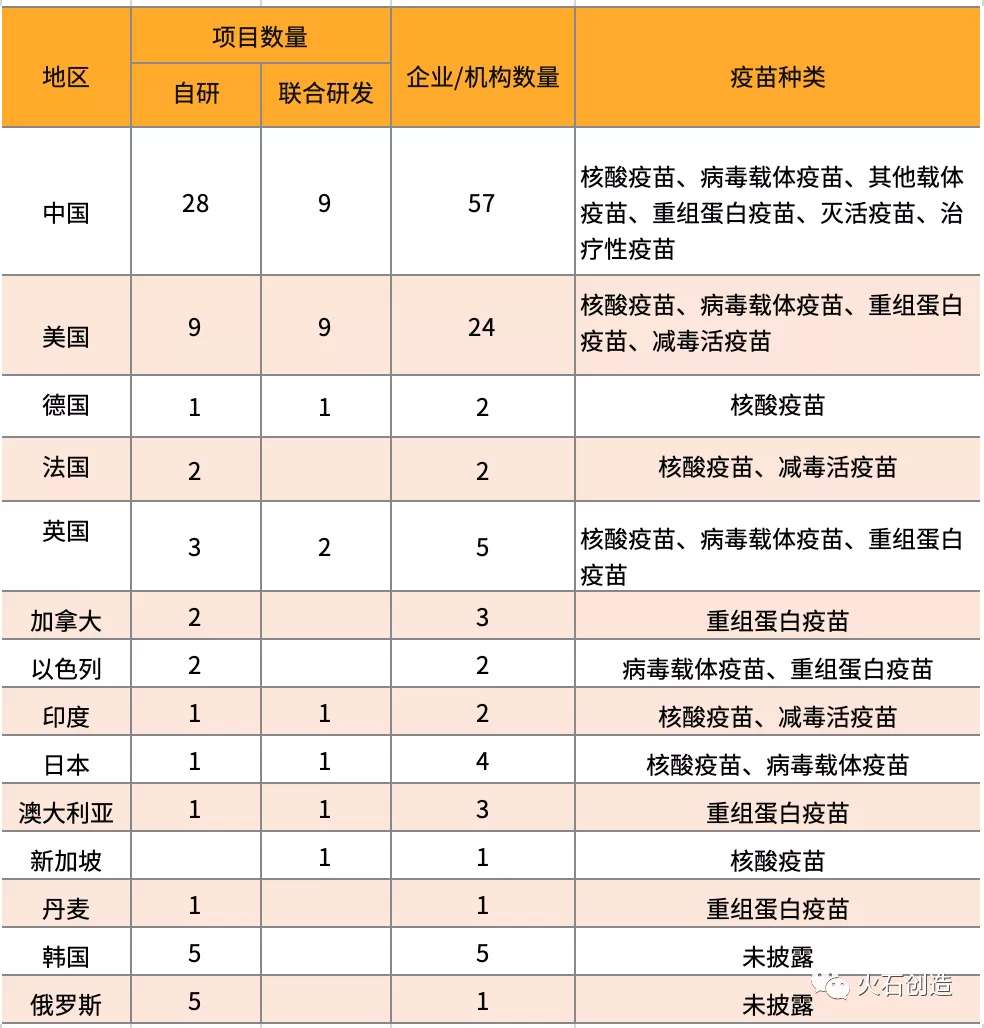
随着新冠疫情在全球的大爆发,相对于当前所采取的措施,疫苗是针对病毒防控zui好的措施。在疫情发生后,国内外多家企业和科研机构便开始了新冠疫苗的研发工作。截至3月24日,全球有不少于106家公司和科研机构,正在进行至少73个新冠病毒疫苗项目的开发工作。项目以中国和美国为主,中国在研相关项目37个,包括与国外联合研发9个;美国在研项目17个,包括与国外联合开发9个。
表1 全球疫苗研发区域分析
常见疫苗种类和特性
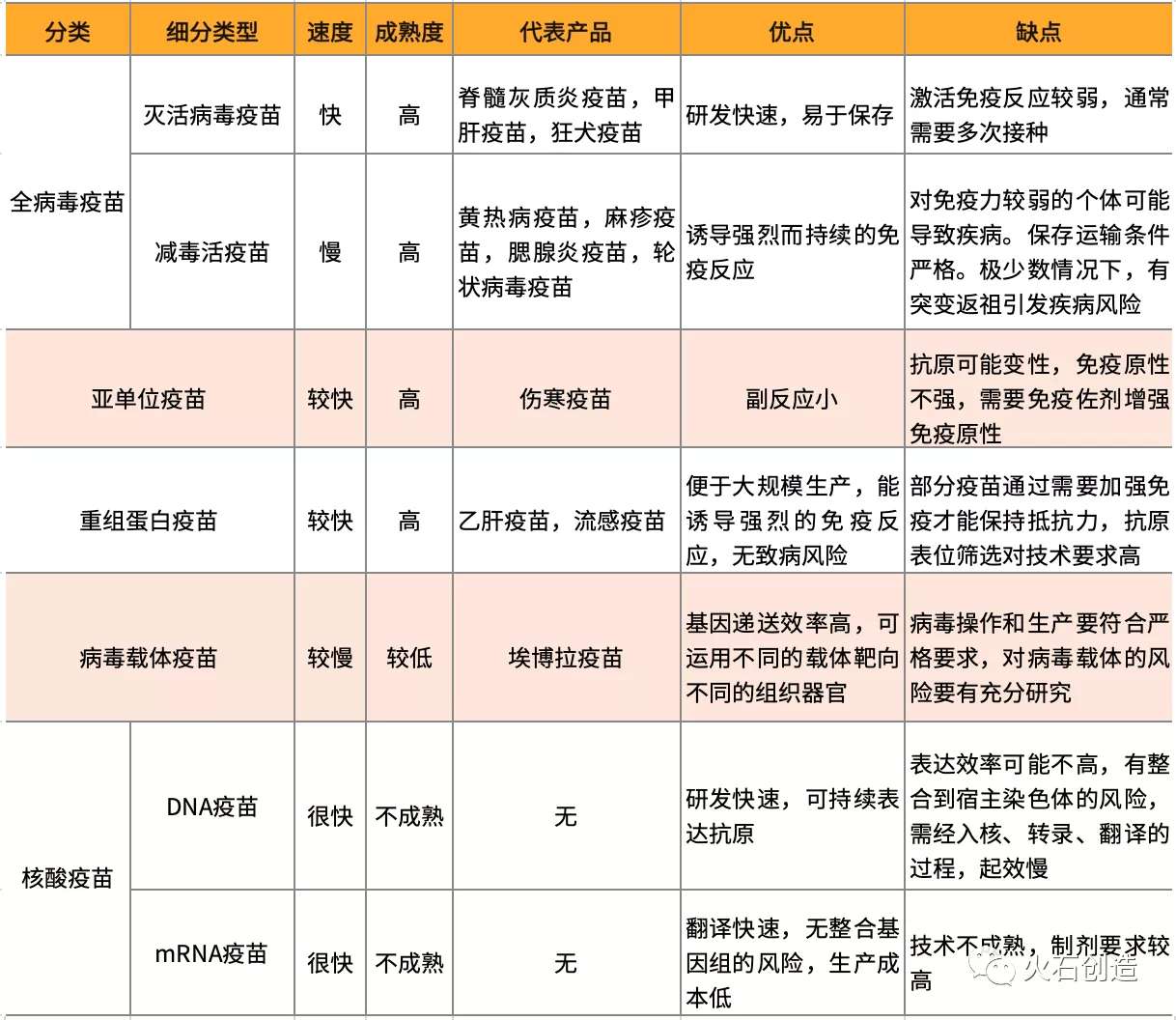
随着疫苗技术不断发展,目前市面上应用广fan且成熟的疫苗主要是灭活病毒疫苗、减毒活疫苗和亚单位/重组蛋白疫苗,近年来,新兴的病毒载体疫苗和核酸疫苗因其独特的优势,也在快速研发和验证中。本次疫情的突发性,更加突显了新技术疫苗应用的重要性。
1. 全菌疫苗(全病毒疫苗)
全病毒疫苗通过将病毒灭活或降低病毒毒力的方式制作能激活免疫反应的疫苗。
灭活的病毒疫苗通过化学(通常是福尔马林),加热或辐射等方式处理病毒,使病毒失去毒性,但保留其主要抗原特征,仍然能够激活人体的免疫反应。常见的全病毒疫苗包括脊髓灰质炎疫苗、甲肝疫苗、狂犬疫苗和一些流感疫苗。灭活病毒疫苗的免疫原性低于减毒活疫苗,通常需要多次接种才能激活足够的免疫反应。
减毒活疫苗是通过筛选获得的不致病的病毒株系,通常采用将病毒在非天然宿主细胞中传代的方法来筛选减毒活疫苗。病毒为了生存并感染非天然宿主细胞,将会产生突变,并适应在新宿主细胞中复制,经过多次传代后,渐渐无法在天然宿主中正常繁殖。常见的减毒活疫苗包括黄热病疫苗、麻疹疫苗、腮腺炎疫苗、轮状病毒疫苗和天花疫苗等。
减毒活疫苗与天然病原体相似度很高,因此可以诱导强烈而持续的免疫反应,通过1至2次接种就可以提供终生免疫力。但对免疫力不足、有慢性病或器官移植的个体接种,可能导致疾病。减毒活疫苗保存和运输条件严格,需要冷藏维持疫苗活性。ji少数情况下,减毒活疫苗有突变返祖而引起疾病的风险。
全病毒疫苗应用历史悠久,有大量成熟产品,但诸多缺陷也限制其长远发展,特别在应对突发疫情时不能满足需求,下文将结合疫情讨论。
2.亚单位疫苗
亚单位疫苗通过化学分解或蛋白水解方法使病毒蛋白分离,筛选并保留其中一部分有免疫活性的片段。常见的亚单位如伤寒疫苗。亚单位疫苗的副反应较小,但抗原表位筛选的技术不成熟,并且分离得到的蛋白可能变性,导致免疫原性不强,需要免疫佐剂增强免疫原性。
3. 重组蛋白疫苗
重组蛋白疫苗运用基因工程重组技术,通过细菌或酵母等载体表达病毒外壳中免疫原性较强的蛋白,诱导机体的免疫反应。常见应用包括乙肝疫苗和流感病毒疫苗等。重组蛋白疫苗可以通过将表达蛋白的基因序列导入酵母等微生物进行大规模生产。该类疫苗利用病毒zui具有免疫原性的部分制成疫苗,能诱导较强的免疫反应,但由于只使用单一蛋白成分,有时需要通过加强免疫才能保持免疫力。重组蛋白疫苗没有致病性,可以应用于免疫缺陷或有慢性病个体的接种。
4. 病毒载体疫苗
病毒载体疫苗原理与基因治疗相同,是利用不具有治病性的病毒作为载体,通过保护性抗原基因重组到病毒中,在人体产生疫苗,激活机体免疫反应获得免疫力。病毒可以在人体特定部位或器官表达抗原,且本身具有免疫原性,能激活免疫反应。病毒载体疫苗基因递送效率高,但对载体的选择有较高的技术要求,对病毒载体的操作和生产也有严格的规范要求。
通常选择的病毒载体,一种是复制缺陷性病毒载体,病毒保留了完整的结构和感染力,但自我复制功能丧失,需要特定转化细胞或辅助病毒等的帮助进行繁殖,从而使人体产生有效免疫力;另一种是有复制能力的病毒载体,它们可作为外源基因的载体而保持自身传染性。目前,用作载体的病毒主要有腺病毒和痘病毒等,以及利用已经获批上市的减毒流感疫苗作为载体。
目前应用zui成熟的是腺病毒载体,对腺病毒载体的改造已有充分研究,腺病毒载体基因组稳定,宿主范围广,不整合到人体基因等优点。在产能上,也可以通过293细胞培养易于实现产业化。但腺病毒是常见的呼吸道病原体,人体普遍存在腺病毒的中和抗体,这些预存的中和抗体会降低腺病毒载体疫苗诱导的免疫反应;同时,腺病毒传染性ji强,载体制备时需避免腺病毒引起的隐性感染,是腺病毒载体疫苗研发中面临的问题。
目前世界上获批的病毒载体疫苗,有天津康希诺的以腺病毒5型为载体的埃博拉疫苗在中国获批,和MERCK的以VSV为载体的埃博拉疫苗在FDA获批。国内有多家符合GMP标准的CMO企业可以生产。
5. 核酸疫苗
核酸疫苗包括DNA疫苗和mRNA疫苗,是近些年兴起的新型疫苗,通过将编码疫苗的DNA或mRNA直接注射入人体,利用人体细胞产生疫苗,引起人体的免疫应答。核酸疫苗制备简单,但规模化生产能力有待考验。目前世界上还没有获批产品。
DNA疫苗是表达病毒蛋白的DNA,被递送入细胞后,DNA进入细胞核,转录为mRNA,再在细胞质中翻译成蛋白质,蛋白被呈递到细胞表面,激活免疫反应。DNA疫苗易于生产和储存。DNA通过电穿孔或脂质体膜融合等方式进入细胞,其效率能否满足需求仍需要论证。并且DNA有整合到宿主染色体和诱导自身免疫病的风险,此外,DNA疫苗需经入核、转录、翻译的过程,起效较慢。
mRNA疫苗与DNA疫苗基本原理相似,但mRNA无需进入细胞核,在细胞质就能快速翻译,且mRNA本身可以作为免疫佐剂,进一步促进免疫反应。mRNA会通过生理代谢途径降解,副作用小,无整合基因组的风险。mRNA生产简单快速,运输成本低。但mRNA容易降解,需要通过修饰提高稳定性,大批量生产需要纳米脂质体技术保护mRNA,目前拥有该技术,并能够进行规模化生产的公司较少,仅BioNTech、Moderna和CureVac以及国内的斯微生物具备。mRNA疫苗进展zui快的已进入临床II期,如Moderna的巨细胞病毒(CMV)mRNA疫苗mRNA-1647。
6.其他疫苗
除了前面几类当前研究应用比较多疫苗,像治疗性疫苗和细胞性疫苗等一些新型疫苗,也已经有了很大的发展。
治疗性疫苗:与预防性疫苗不同,治疗性疫苗是在机体已经感染病原微生物或已经患病的情况下,用来诱导机体进行特异性免疫应答,从而达到治疗或阻止疾病恶化的疫苗。近几年研究火热的HIV治疗性疫苗、HPV治疗性疫苗、乙肝治疗性疫苗等都属于这类疫苗。
细胞性疫苗:是以细胞为载体,让病毒的目的蛋白在细胞上表达,避免了病毒本身的致病性问题。此次,上海市公共卫生临床中心便应用人源细胞为载体,开发人源细胞载体疫苗。
表2 不同类型疫苗的特点对比
新冠病毒疫苗的类型与发展趋势
根据新冠病毒疫苗研发项目,48个已披露信息的项目涉及59个已公布类型的疫苗,其中核酸疫苗zui多,有18个在研项目,占30.5%,其次是亚单位/重组蛋白类疫苗和病毒载体疫苗,分别有16个和13个,而减毒活疫苗和灭活疫苗数量很少,充分显示出新技术在快速疫苗研发中的作用。
重组蛋白疫苗应用成熟,研发与制备快速,机制明确,因此成为本次抗疫的主力之一。但重组蛋白疫苗通常靶向变异率较高的病毒S蛋白,一旦S蛋白发生变异,该类疫苗将会无效。因此,开发多价疫苗可以有效弥补该缺陷,而病毒载体疫苗和核酸疫苗也可以通过同时表达多个抗原的方式避免该问题。
mRNA疫苗虽不成熟,却在本次疫情中爆发式的应用,主要是由于其研发和生产周期短。而zui传统的灭活疫苗和减毒活疫苗已被新技术大量取代。灭活疫苗在处理病毒前要大量培养病毒,而新冠病毒的培养与操作需在生物安全3级(BSL-3)实验室中进行,疫苗研发企业都不具备相应的条件,产品产业化有较大挑战;减毒活疫苗需要通过多次传代筛选合适的病毒株系,研发周期太长,难以应对突发疫情。
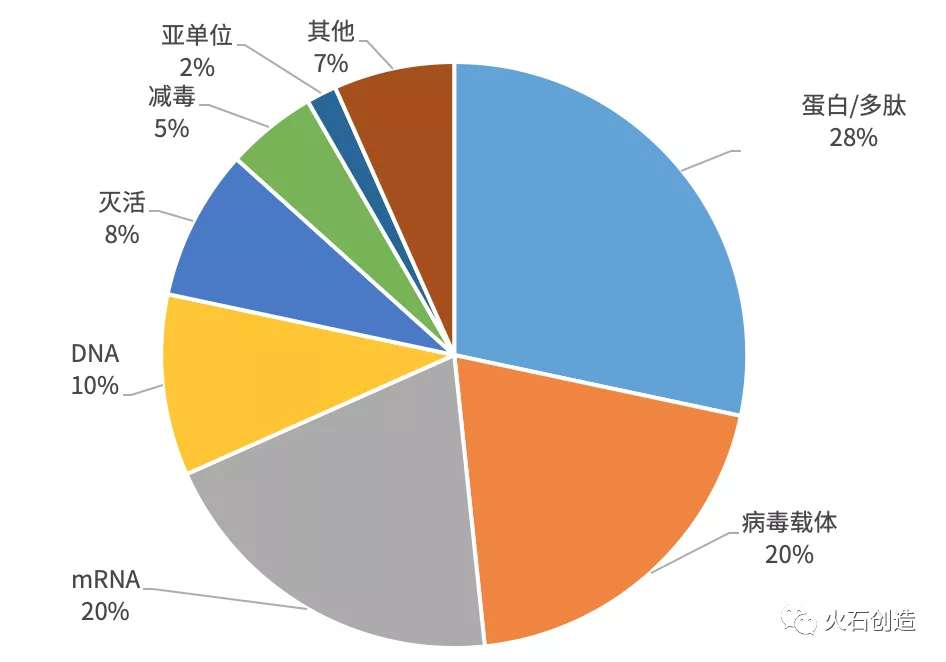
图1 新冠病毒疫苗类型占比
在今后的疫苗研发趋势中,亚单位/蛋白疫苗/多肽仍然是主流形式,而核酸疫苗将会后来居上,成为新的主流疫苗形式,并日趋成熟,病毒载体疫苗由于效率高和靶向特定器官的特殊优势,在应对某些特定病毒上是较好的选择。
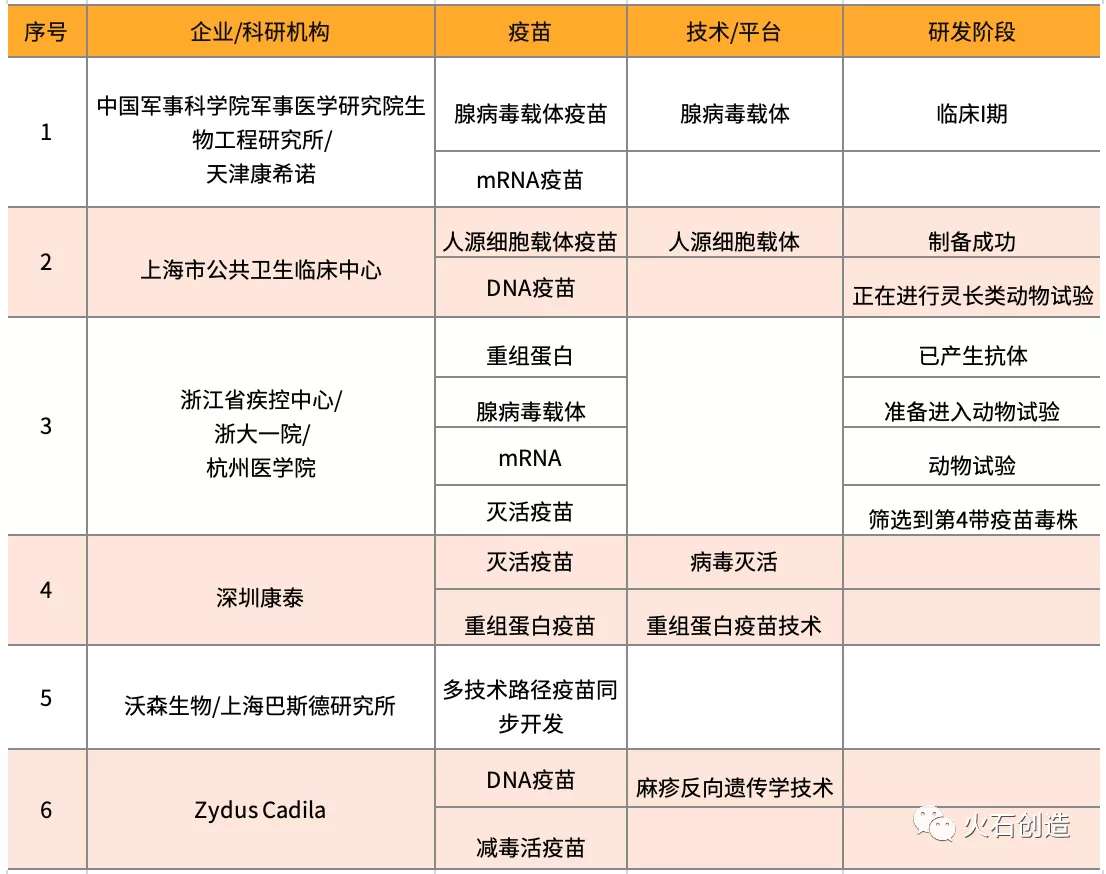
信息披露较详细的48个项目,多是针对单一技术路径进行研究,有6个项目同时进行两个以上路径的研究。
表3 多技术路径项目
1.核酸疫苗
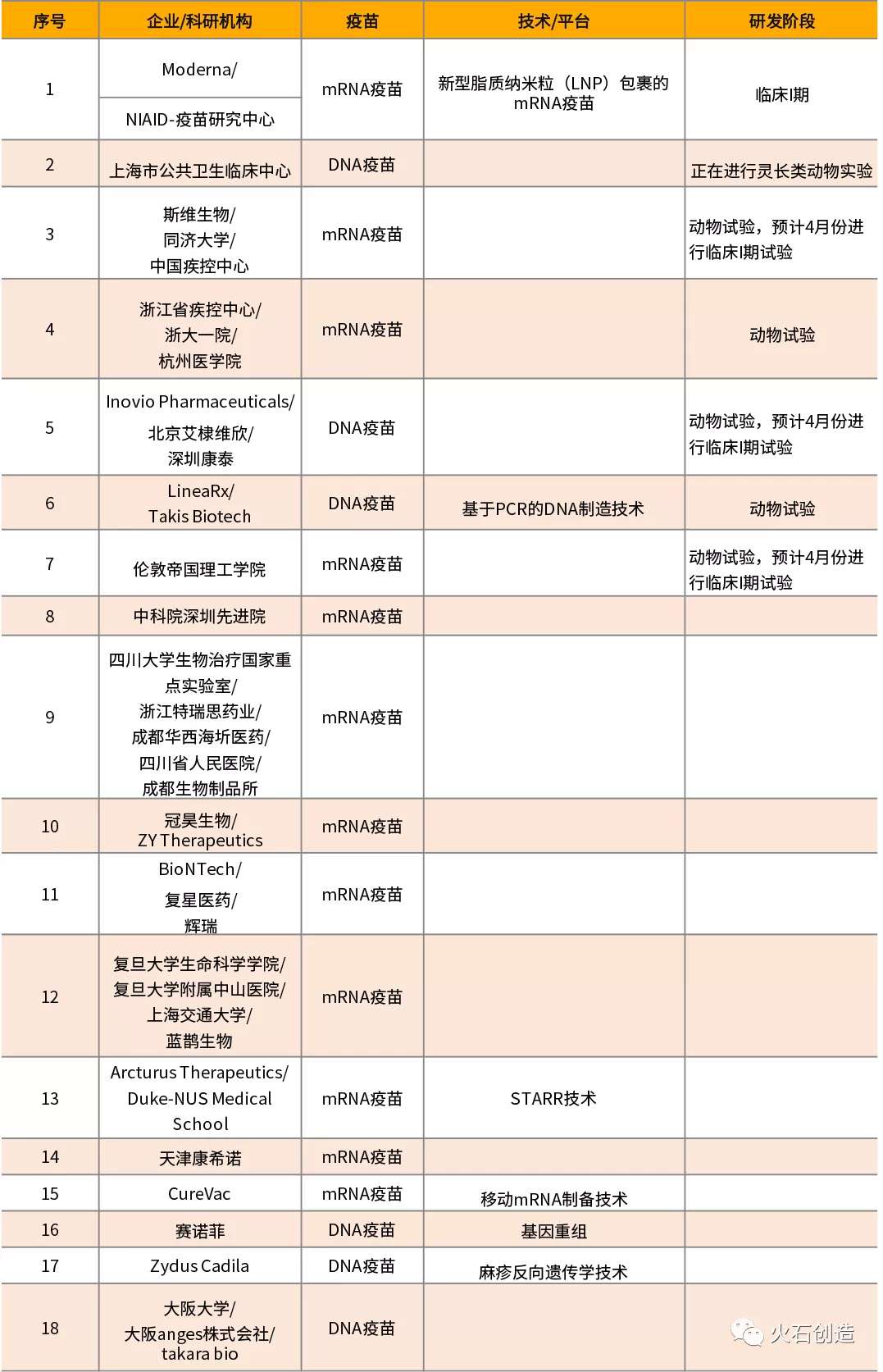
核酸疫苗是当前研究项目、研究企业和科研机构zui多的疫苗。核酸新冠疫苗,是将新冠病毒的S蛋白基因直接注射入人体,在人体内表达S蛋白,引起人体的免疫反应。相比其他类型疫苗,整体开发速度更快。正在研究的18个核酸疫苗项目中,有12个mRNA疫苗,6个DNA疫苗,其中已有1个进行临床研究,6个正在进行动物试验,3个预计4月份进入临床研究。
2月26日,上海市公共卫生临床中心的徐建青研究员给自己注射了DNA疫苗,成为全球di一个进行人体注射的新冠疫苗。
3月16日,美国国jia过敏与传染病研究所(NIAID)与美国生物科技公司Moderna联合开发的mRNA-1273新冠疫苗,开始进行45人的临床I期试验,是全球di一个开展临床研究的疫苗。值得注意的是,该疫苗未经过动物药效试验验证,直接进行了临床试验,进一步证明了研究人员对mRNA疫苗所具有的安全性的信心。
Inovio在我国科学家公布新冠病毒基因序列3小时后设计出了新冠疫苗,同时宣布zui快将于今年夏天开始临床试验。目前,Inovio联合北京艾棣维欣和深圳康泰开发的DNA疫苗,预计在4月份将进行临床试验,研究进展大于预期。
表4 核酸疫苗项目名单
2. 亚单位/重组蛋白/多肽疫苗
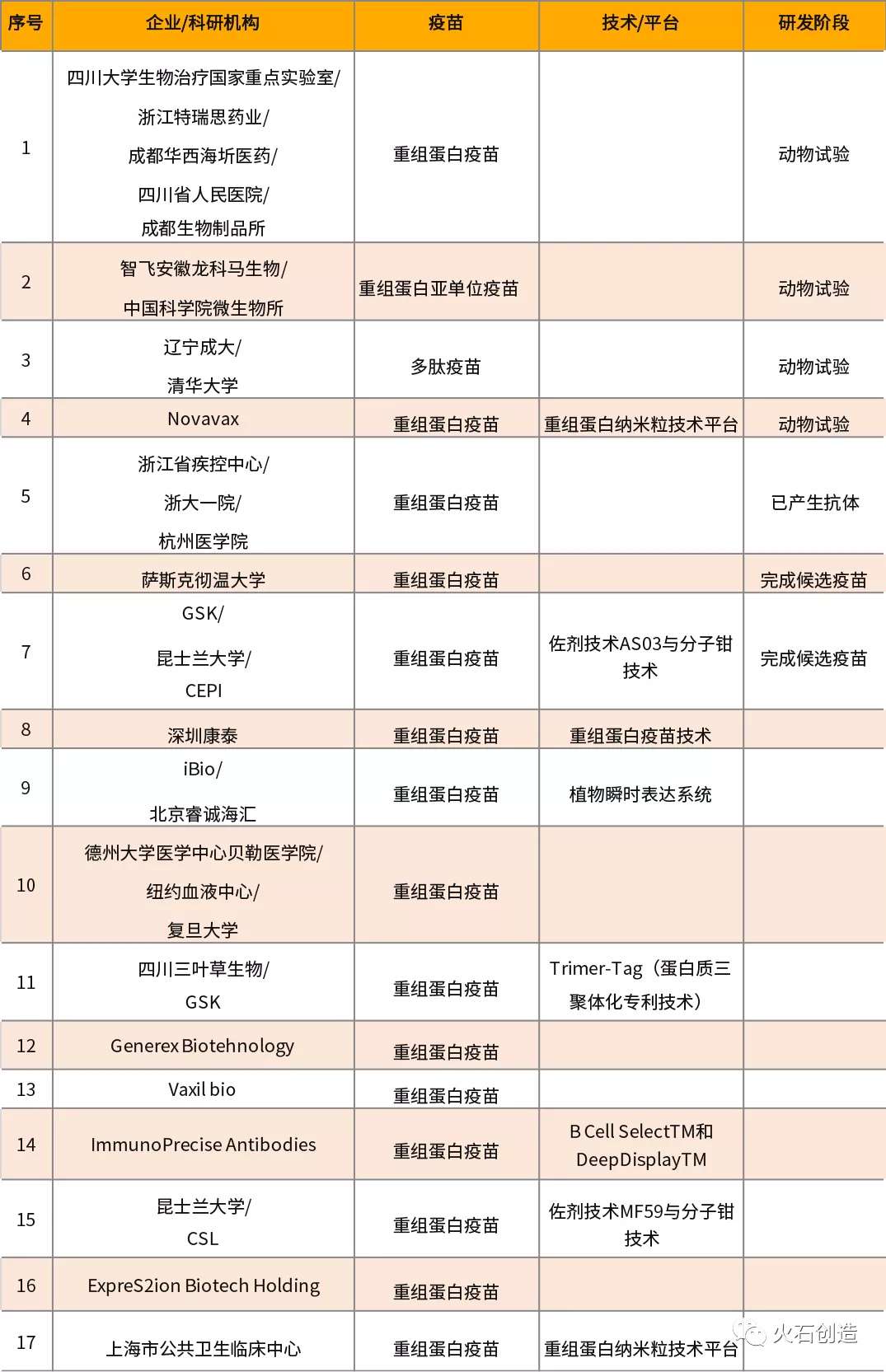
重组蛋白疫苗是于把病毒的S蛋白基因整合到真核表达系里,然后经过体外大量培养,表达出病毒的S蛋白,经过提纯制成疫苗。目前速度相对较快,17个项目有4个项目进入动物试验,1个已产生抗体,2个完成候选疫苗,11个项目在研。其中,重组蛋白疫苗占jue对优势,亚单位和多肽疫苗各有1个。
上海市公共卫生临床中心和Novavax都在进行纳米颗粒疫苗的研发,通过基因工程技术将病毒膜蛋白组装形成一个纳米颗粒,能够保证速度和安全,但是研发时间较长。
表5 重组蛋白疫苗项目名单
3.病毒载体疫苗
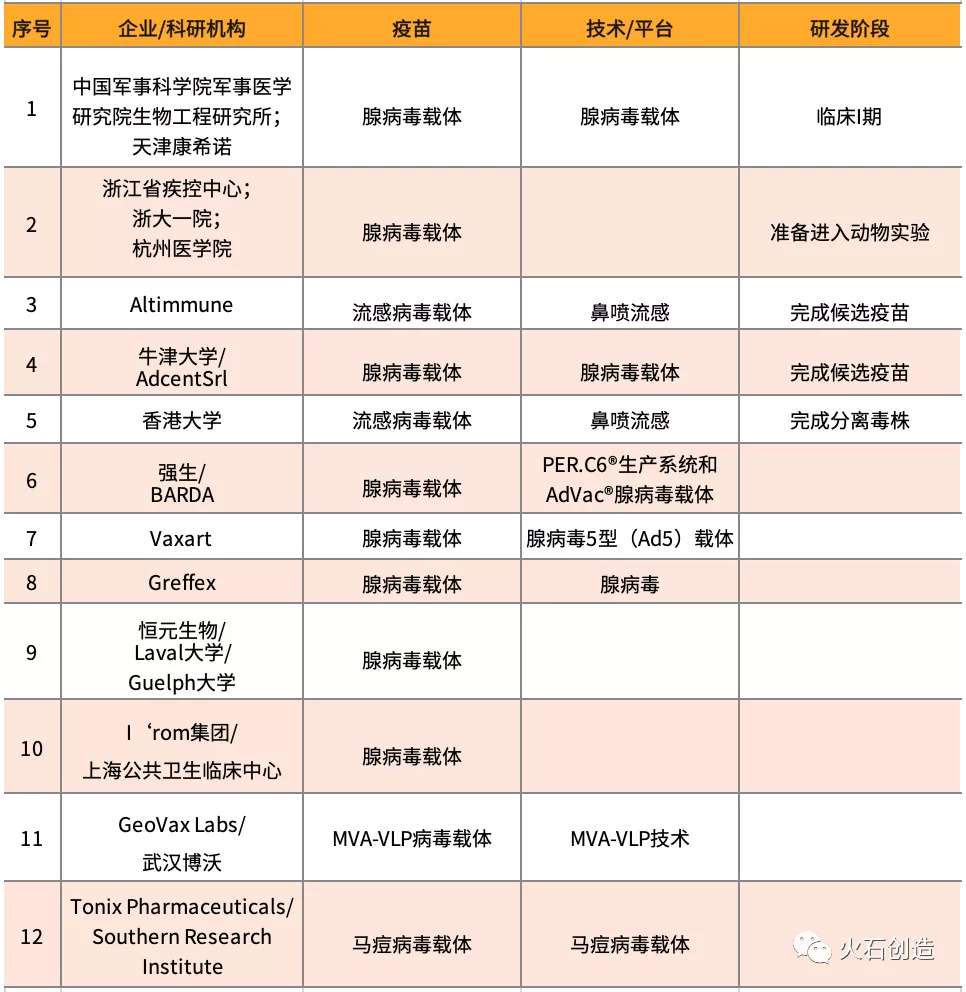
当前的研究中,病毒载体疫苗采用了腺病毒载体、流感病毒载体、MVA-VLP病毒载体和马痘病毒载体4种病毒载体。是将新冠病毒的S蛋白基因转入病毒载体,然后注射入人体,在体内表达S蛋白,引起机体免疫反应。以腺病毒载体疫苗为主,有8个疫苗在研;流感病毒载体疫苗有2个;其他两种各1个。
病毒载体疫苗的整体研发进度较慢,除了1个进入临床试验外,均未进行动物试验。当前,浙江疾控中心的项目正在准备动物试验,2个完成疫苗候选,1个完成分离毒株。
军事医学研究院生物工程研究所和天津康希诺联合开发的重组新型冠状病毒(2019-COV)疫苗(腺病毒载体),在3月16日获批进行临床试验,截至3月22日,已对108名志愿者进行人体注射。相比Moderna的mRNA新冠疫苗,该疫苗经过了动物试验的验证,实验数据更为完善可靠。
表6 载体疫苗项目名单
4.灭活病毒和减毒疫苗
由于灭活病毒疫苗激活免疫效应比减毒疫苗较差,减毒疫苗研发周期较长,项目进展相对较慢,面对快速应对疫情的需求,项目相对较少。灭活病毒疫苗有5个项目在研,减毒疫苗有3个项目在研。浙江省疾控中心的灭活疫苗进展相对较快,已经筛选到第4代疫苗毒株。
表7 灭活病毒和减毒疫苗项目名单

5.其他疫苗
当前,除上述几种疫苗外,还有治疗性疫苗、人源细胞载体疫苗、酵母载体疫苗等。
贝达药业联合北京鼎成、杭州瑞普基因正在开发2019-nCoV新型冠状病毒通用DC治疗性疫苗。其具有靶向清除病毒感染细胞的功能,精zhun高xiao、安全,是全球唯yi的兼具治疗和预防功能的新冠疫苗,目前处于早期研发阶段。
上海市公共卫生临床中心的人源细胞载体疫苗是世界shou个以人源细胞为载体的疫苗。是将病毒的S蛋白表达在人的细胞膜上,能够ji大地提高疫苗的安全性,而且不需要分离病毒与病毒扩张,具有总体快速、安全、高xiao的特点,已开始进行灵长类动物试验。
天津大学的食品ji安全酵母载体口服疫苗,以食品ji安全酿酒酵母作为载体,以新型冠状病毒S蛋白作为靶点产生抗体。目前,已完成了重组菌株构建等核心技术开发。
总结
就当前新冠疫苗研发进度而言,核酸疫苗、亚单位/重组蛋白/多肽疫苗、病毒载体疫苗作为新型疫苗,充分显示了技术上的优势,整体研究进度超出预期。灭活病毒疫苗的研发生产受P3实验室的限制,大规模培养、产业化难度高;减毒疫苗受技术的影响,研发周期长,两者在当前疫情中不具有优势。
核酸疫苗和病毒载体疫苗各有1个项目进入临床研究,在当前更受瞩目。国外mRNA疫苗越过动物试验直接进入临床试验,国内病毒载体疫苗临床前研究也不完整,安全性、有效性等诸多问题难以证明,生产工艺和质控标准尚待完善。重组蛋白疫苗暂时没有项目进入临床,稍落下风,但技术相对成熟,安全性高,后期更具优势,ji有可能批量进行临床试验。但受疫情快速发展的影响,加快研究进度,简化疫苗研发流程,有其合理必要性。
不过,从前面研究的冠状病毒疫苗中发现,经常会有免疫增强的发生,甚至对身体造成致命的伤害,如何避免潜在免疫增强所造成的机体损伤,也成为研究中需要解决的问题。同时,关于疫苗的认知还有不清楚的地方,这都决定了新冠疫苗的研究不会一蹴而就,可能还需要相当长的时间。
由于对疫苗的认识有限,同时,新冠疫苗的研究依旧在进行中,我们的认知也会不断深入和改变,接下来我们会继续对新冠疫苗的研究保持关注,及时的发布相关信息。


