生物药中RNA与小核酸
文章来源:AVT发布时间:2022-02-08浏览次数:
本期AVT小编给大家带来生物药中RNA与小核酸的相关的资讯分享,一起来了解一下吧!
二十年前诺奖发现为新药研发提供思路
1998年,Andrew Fire和Craig Mello发表了一篇开创性的论文,确定双链RNA(dsRNA)是秀丽隐杆线虫的转录后基因沉默(PTGS)的病原体,这种现象被称为RNA干扰(RNAi)。
而后的2001年,Elbashir等人首ci在哺乳动物细胞中观察到RNAi现象,自此打开了RNAi技术在哺乳动物细胞中研究应用的大门。在不久后的2006年,Andrew Fire和Craig Mello因在真核生物中发现RNA干扰现象而获得了诺贝尔生理学或医学奖。
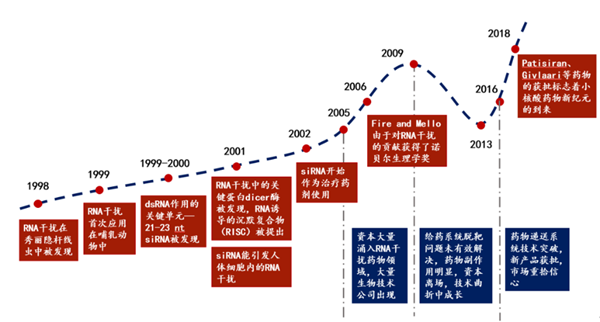
图1:RNAi发展历程
RNAi药物相比目前蛋白水平发挥作用的药物,具有更为独特的优势:RNA药物的特点在于它们可以直接与mRNA结合并造成其降解,从而防止致病蛋白质被转录。另一个优势是RNA药物可以轻易地将其与现有疗法合并使用。具有独特优势的小核酸药物本应该可以在医药市场上拔得头筹,但是由于小核酸药物潜在的靶向安全性问题,其药物的研发曾一度受到各大知名药企和投资者的摒弃。直到2018年,Alnylam公司的Patisiran(用于治疗成人遗传性转甲状腺素蛋白(hATTR)淀粉样变性引起的周围神经病变--又称多发性神经病)在美获批上市,才真正填补了这个市场领域的空白。
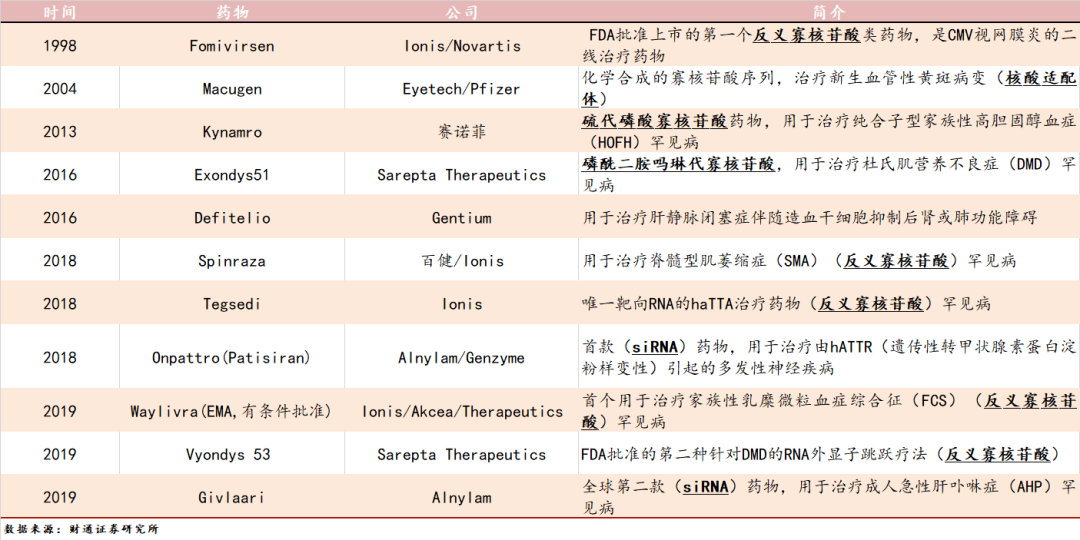
表1:1998年-至今已上市的小核酸药物
RNAi目前认知的作用机理
siRNA、miRNA和piRNA
RNAi由长度为20-30 nt的sncRNA触发,根据sncRNA生物合成和作用机制的不同,可将其分为siRNA(small interfering RNA)、miRNA(microRNA)和piRNA(PIWI-interacting RNA)3种。
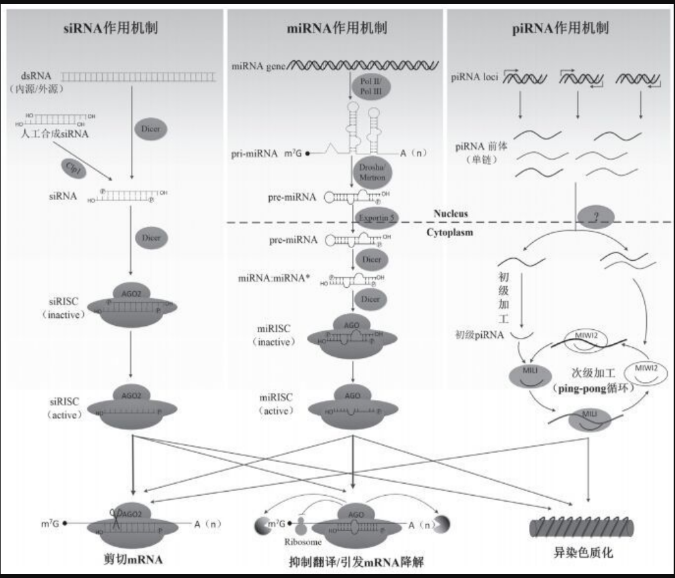
图2:RNAi作用机制
反义核酸ASO
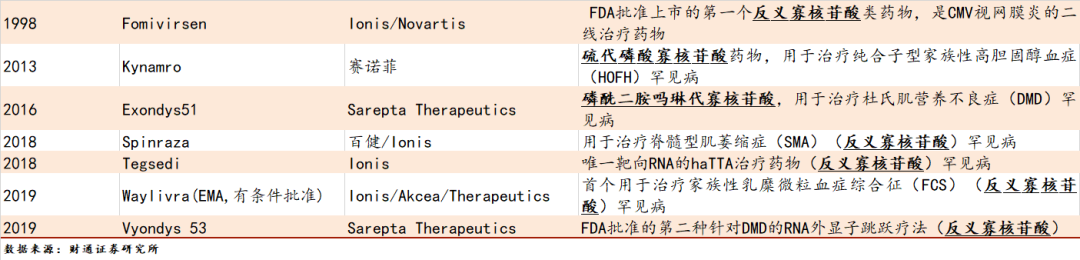
反义寡核苷酸(ASO)是一种合成的单链寡核苷酸,具有不同的化学成分,包含与靶RNA转录物互补的序列。ASos具有广的应用,包括阻断mRNA的翻译、竞争性抑制miRNA、沉默靶miRNA、外显子跳跃、外显子包合和核酸酶H介导的靶降解。在这些应用中,靶向核酸酶H介导的降解是最有效的。目前,ASO已有多款药物获批,领先公司Ionis已证明ASO药物成药性上的可行性。
表2:ASO已有多款药物获批
其他小RNA研发热点
目前,环状RNA(circular RNA,circRNA) 、long noncoding RNA (IncRNA)等亦是学界关注的热点,如目前学界认识到circRNA可以作为天然小RNA(miRNA)海绵体吸附并调控miRNA的活性,与转录调控元件结合或与蛋白互作调控基因的转录等。相信未来随着转录组学、表观遗传学等学科的发展,将会有更多的非编码RNA、RNAi机制被发现与认识。
小核酸药物的挑战:递送系统
RNAi要想发挥基因沉默效果,需要先克服诸如核酸酶降解、较短的半衰期、血液循环中的免疫识别、靶组织中的积累、跨膜转运以及从内体和溶酶体逃逸等一系列挑战。虽然通过结合化学修饰,可大大降低核酸的酶稳定性和避免免疫识别,但是,其他问题仍有待解决。而先进的载药系统可以极大程度地解决化学修饰所不能解决的问题,提升RNAi治疗的有效性和安全性,载体系统可谓是RNAi给药的重中之重。
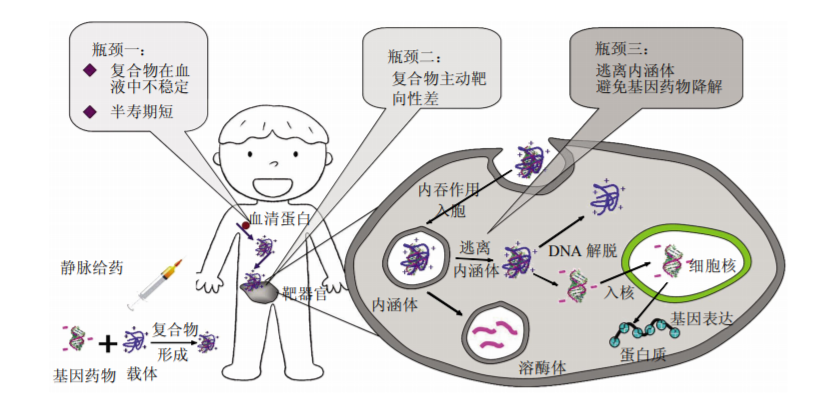
图3:目前基因给药的主要瓶颈
目前针对RNAi给药,全球各大核算领域公司的研发重点都聚焦于规避开现有专利,开发出更有效、更安全的载体系统,各类平台如阳离子脂质体(LNP)、Galnac、exsome、DPC等都孕育而生。
表3:各类RNAi递送系统
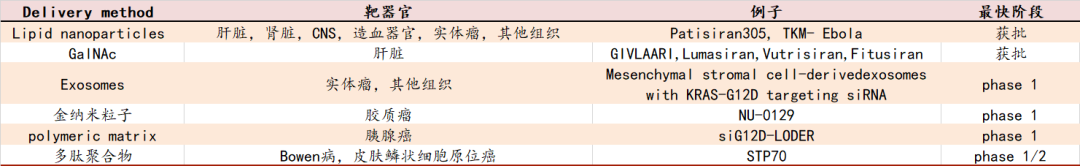
从RNAi现象的发现到全球首kuanRNAi药物的获批上市,这沉寂的20年时间里,其递送系统一直没有得到实质性的解决,限制了小核酸药物的临床开发与应用。而Alnylam公司凭借其脂质纳米颗粒递送系统 (LNP)才让RNAi从安全性的潘多拉魔盒中走来出来,将RNA干扰疗法真正从实验室推向了临床应用,填补了RNAi药物市场的空白。
结语
小核酸治疗的新领域正稳健发展,尽管目前为止仅批准了少数几种RNA药物,但仍鼓舞了其余尚在临床试验阶段的药物。可以肯定的是,未来几年小核酸治疗将在蛋白药物靶点缺乏的现状中,占据更多的市场地位,对现有靶点的蛋白类药物进行补充,同时还可填补尚无相对应药物治疗的蛋白质靶点的疾病。据相关报告预计, 小核酸药物领域将在未来5年内创造100亿美金以上的市场,并且在未来30年内如蛋白类生物药一样,创造千亿美金级别的市场。
本文分享自佰傲谷BioValley《生物药另辟蹊径,小核酸曲径通幽》张文录


