围绕mRNA疫苗AVT给您分享这些资讯,脂质体递送有何优势?
文章来源:AVT发布时间:2020-09-10浏览次数:
本期AVT小编将围绕mRNA疫苗,从递送、给药、专利三个方面分享mRNA疫苗相关资讯,那么脂质体递送有何优势?感兴趣的小伙伴快来了解下!
1990 年,Woiff 等首次证实,体外合成的 mRNA 经肌肉注射至小鼠体内后有活性蛋白产生。这就是 mRNA 疫苗的雏形。
但mRNA自身稳定性差、易被体内的核酸酶降解是制约其发展的瓶颈。因此,mRNA 疫苗需要有合适的递送载体将其递送至体内,才能有更好的免疫效果,开发高效无毒的递送系统是 mRNA 疫苗成功的关键。
生辉此前已经总结了上述几类 RNA 药物的要点(点击查看《瓶颈》)。本文将着重分析 mRNA 疫苗的递送究竟有那几道难题要解答?
第一题:递送载体
相比于 DNA 疫苗,mRNA 疫苗无需进入细胞核,无整合到基因组的风险,相对更安全。mRNA 疫苗既可作为预防性疫苗预防流感等感染性疾病,也可作为治疗性疫苗治疗如癌症等重大疾病。
目前 mRNA 疫苗主要包括非复制型 mRNA 和病毒衍生的自我扩增型 mRNA(self-amplifying mRNA, SAM,图 1)。
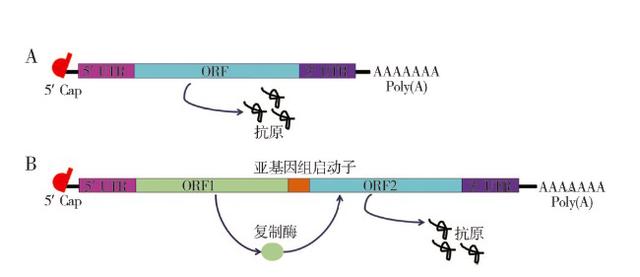
图丨非复制型 mRNA(A)和病毒衍生的自我扩增型 mRNA(SAM)(B)结构组成(来源:J Int Pharm Res,Vol.46,No.5,May,2019 )
非复制型 mRNA 是利用体外转录技术合,与真核生物 mRNA 分子结构一致,主要由 5'非翻译区(untranslated region, UTR)、开放阅读框(open reading frame, ORF)、3'非翻译区、5'帽子结构(Cap)和 100-250bp 多聚腺苷酸尾巴(Poly (A))组成。5'-UTR 和 3'-UTR 中的调节元件可稳定 mRNA 并增加抗原蛋白质翻译。ORF 是含有编码抗原的核酸序列,Cap 能使 mRNA 沿着正确的方向进行翻译。Poly (A)能增加 mRNA 的稳定性和抗原蛋白的表达,对 mRNA 的翻译和稳定性具有重要作用,可经 Poly (A)聚合酶添加到 mRNA 上。mRNA 的合成一般是以含靶蛋白 ORF 的质粒为模板,经体外转录合成,最后再加上 5'Cap 和 3'端 Poly (A)。体外合成的 mRNA 进入细胞后,在核糖体上进行翻译,形成功能性蛋白。
病毒衍生的自我扩增型mRNA(SAM)是将编码抗原的核酸序列直接插入单链 RNA 病毒中(如塞姆利基森林病毒、黄热病毒等),通常相对分子质量比较大,能表达大量的抗原。目前使用的 SAM 疫苗大多基于甲病毒基因组,其中编码 mRNA 复制机制的基因是完整的,只是编码结构蛋白的基因被目的基因替换,利用 DNA 模板经体外转录技术即易得到。
mRNA疫苗递送载体主要包括病毒载体和非病毒载体。以慢病毒、腺相关病毒、仙台病毒等载体为主的病毒载体虽能进行核酸递送,但可能会因载体引起的免疫反应而受到限制,影响其应用。
而非病毒载体主要包括脂质体、树突细胞(dendritic cell, DC)、无机纳米粒子、阳离子细胞穿膜肽等。其中,脂质体递送 mRNA 具有独特优势: 1)脂质体为球形囊泡,可将 mRNA 包裹在内,抵御核酸酶的作用;2)脂质体类似于细胞膜,易与受体细胞融合,转染效率高;3)脂质体可递送不同大小片段的 mRNA;4)脂质体作为递送载体不受宿主限制。截至目前,脂质载体已成为递送 mRNA 最为有效的非病毒载体。常用的递送 mRNA 的脂质体材料见表 1。

(来源:J Int Pharm Res,Vol.46,No.5,May,2019)
目前,用于递送mRNA的非病毒载体中以脂质体应用的最为广泛,主要包阳离子括脂质体复合物 (lipoplex,LP)、脂质体聚合物(lipopolyplex,LPR)、脂质体纳米粒(lipid nanoparticle,LNP)、阳离子纳米乳(cationic nanoemulsion,CNE)等。
最早使用的脂质体递送材料是阳离子脂质体。带正电荷的阳离子脂质体与带负电荷的 mRNA 通过经静电作用聚集形成多层囊状复合物,称为脂质体复合物 (lipoplex,LP),复合物中包封的 mRNA 不易被 RNase 降解,能被成功递送至细胞翻译成功能性蛋白。2-二油酰基羟丙基 - 3-N,N,N - 三甲铵氯(DOTAP) 和二油酰磷脂酰乙醇胺(DOPE) 是已被证实有效的递送载体。
阳离子聚合物具有浓缩mRNA的作用,mRNA与聚合物浓缩后被阳离子脂质体包裹在囊状空腔中则形成脂质体聚合物(lipopolyplex,LPR)。LPR 最早用于DNA转染,后来也用于siRNA和mRNA转染。
脂质体纳米粒LNP一般由被脂质双层壳包围的水性核心组成,脂质双层壳由不同的脂质组成,每种脂质都发挥着不同的功能。LNP 是目前主流的递送载体之一,然而,早期的阳离子 LNP 在体内的应用仍然受到很大限制,比如容易被巨噬细胞清除和产生有害的活性氧簇 ROS 等。
为了解决这些问题,“可离子化”LNP 的概念被提出。虽然大大促进了核酸药物的发展,但仍然不尽人意。纳米颗粒的体积比较大,一般需要静脉注射,只能有效进入肝脏,脾脏和肿瘤等空隙较大的组织。另外,LNP 的过敏反应也比较严重,在注射之前需要使用抗组胺和激素药物控制。这些缺点让 LNP 药物只适用于罕见病和癌症等严重疾病。
Brito 等使用阳离子纳米乳 (cationic nanoemulsion,CNE) 递送不同种类的 SAM 疫苗,该 CNE 配方是基于诺华专利佐剂 MF59。相比于 LNP,CNE 已用于临床试验,具有更重要的临床意义。
即使许多药物(如生化药物抗癌抗真菌药物、基因药物、麻醉剂)通过脂质体进行递送,并取得了成功,但是由于脂质体本身存在一些缺点,如易氧化降解、制备重现率差等,大规模工业化生产不易实现等问题都有待解决,同时由于传统脂质纳米粒的开发过程进展缓慢,目前开发出来的有效递送载体非常有限。
而递送载体只是待破解的难题之一,与其正相关的给药机制同样不明朗。
第二题:给药方式
mRNA 疫苗的给药方式非常重要,会决定mRNA疫苗在体内的代谢,及目的抗原蛋白翻译的效率。例如,如果直接静脉注射未经任何处理的裸露 mRNA,就会被血液中的核酸酶迅速降解。
mRNA 疫苗的给药分为系统给药或者局部给药,根据抗原蛋白需要表达的位置来决定(下图所示为系统给药和局部给药)。如果是预防性疫苗,为了引起较强的免疫反应,通常用皮下和肌肉注射的局部给药,如果是治疗性 mRNA 疫苗通常通过腹腔或者静脉注射系统给药。
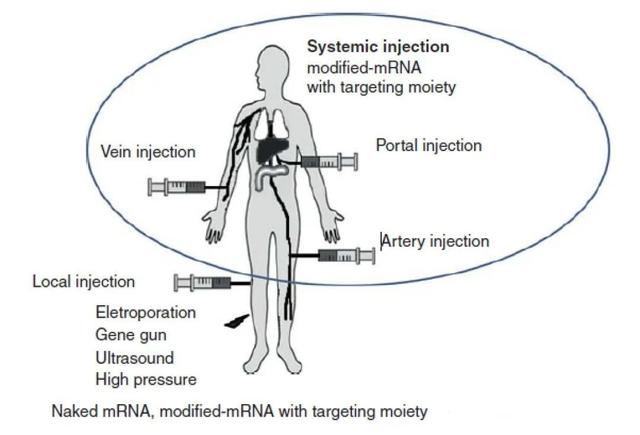
图丨系统给药和局部给药(来源:Biomaterials for mRNA delivery)
同时,对于脂质体递送 mRNA 来说,不同的给药途径对诱导蛋白表达、给药频率及副作用强度具有重要影响。如 LNP 递送可通过改变给药途径来改变 mRNA 体内表达量和持续时间,其中,肌注和皮内注射显示出比静脉注射更持久的蛋白表达。
研究表明,脂质体主要的给药方式有以下 5 种类。
1)静脉注射。一种全身给药的方式,药物经血液流经全身,药效发挥迅速,也是脂质体递送 mRNA 常用的给药方式。脂质体在静脉注射后首先被富含网状内皮细胞的组织 (肝、脾) 摄取,而后被单核巨噬细胞吞噬,少量被肺、骨髓摄取。因进入血液中的脂质体大小及电荷不同,其在血液中清除速率也不一样,大的脂质体清除速率要比小的快。静脉注射不可避免的缺点是脂质体中若残留有制备时产生的毒性溶剂,会对机体产生比其他给药方式更大的副作用。
2)皮下注射。是常规疫苗接种第二种最常用的给药方式。皮下注射是将 mRNA 递送至皮肤和骨骼肌之间,这种给药方式可直接转染 mRNA 至淋巴结中的 DC,但皮下注射对剂量有一定的限制,若给药剂量过多需要分点注入,操作难度大。
3)肌肉注射。将 mRNA 递送至肌肉组织内。这种给药方式的优点是容易实现大剂量给药,但对粒径和电荷具有特殊的要求,粒径和电荷较大则会减少递送,影响药效。
4)皮内注射。可直接将脂质体递送至表皮和真皮之间。表皮和真皮之间具有大量免疫细胞(朗格汉细胞、DC 亚型),皮内注射给药可有效诱导 Th1(辅助性 T 细胞 1) 型免疫应答。但其与皮下注射缺点相同,均无法实现大剂量给药,需要分点注射或多次给药才能达到所需治疗剂量。
5)DC 细胞的转染。mRNA 疫苗另外一种非常重要的给药方式是通过 DC 细胞的转染进行给药,分为体内和体外两种 DC 细胞介导的方式。DC 细胞是人体重要的抗原递呈细胞,其摄取抗原后可以诱导随后的免疫反应。在体外分离得到人体未成熟的 DC 细胞后,可以通过电穿孔技术转染 mRNA,再把转染后的 DC 细胞过继入人体,产生被动免疫。
但是通过体外 DC 转染的方式递送 mRNA 疫苗对技术的要求非常高,需要较长的体外培养时间,而且首先需要获取人体的 DC 细胞,在普通条件下难以实现。另外一个通过 DC 细胞给药的方式是淋巴内给药,mRNA 被直接注射到淋巴内,这样 mRNA 就可以被淋巴内固有 DC 细胞获取,但是这种给药方式通常需要手术辅助,导致给药非常复杂且带了大量的风险。
综上所述,以上 5 种给药方式虽为常用的疫苗给药方式,但具有各自的优缺点,使用哪一种给药方式要根据具体情况分析。
现阶段,受制于递送效率,mRNA 分子只有极少(0.01%)能成功进入细胞质并表达蛋白,因此大剂量给药仍是常态,将会带来较大的副作用。只有选择合适的给药方式,脂质体才能更好递送 mRNA,使其以更小的剂量、更少的副作用,激发起更大的免疫效果。
第三题:专利护城河
全球范围内,尚无基于 mRNA 技术平台研发的治疗或预防性药物、疫苗获批上市。国外有“mRNA 疫苗研发三巨头”:Moderna、CureVac、BioNTech,均采用脂质纳米技术递送(LNP),这也是目前在核酸药物领域应用比较广泛的递送技术类型。
其中,Moderna 专注于 mRNA 药物的开发。这家公司 2010 创立;2011 年正式运行;2018 年上市,创造了美股史上最大生物科技公司 IPO 记录。但技术、专利本身存在的问题让 Moderna 一直处于风口浪尖。
最核心的争议是 Moderna 的核心技术及其专利保护能力。
首先是mRNA药物最为关键的递送问题。Moderna 最初使用的脂质体技术会激活强烈的炎症反应和肝毒性 (特别是在重复注射时),直接导致了早期产品线的失败。
Moderna 宣称在后续产品使用了自己开发的新型脂质体递送技术,然而,首个质疑的声音来自 Arbutus——Arbutus 怀疑 Moderna 至少在两个最领先的产品中非法使用了 Arbutus 的 LNP 递送技术,随后 Arbutus 提出了一场关乎 Moderna 关键产品命运的法律诉讼。
Moderna 先后 4 次从获得 Arbutus 授权的 Acuitas 取得 LNP 技术的使用资格,然而,根据当初 Arbutus 与 Acuitas 的授权协议,Acuitas 只在“antisense”和“gene therapy” 两个领域拥有 LNP 技术的使用和二次授权权利,同时还限定了在二次授权时,所授权的产品必须由 Acuitas 开发、并已在动物模型中完成初步验证。因此,Arbutus 指控 Moderna 与 Acuitas 的授权协议涉嫌重大违约:Acuitas 将所有基于 LNP 技术的专利和技术要点都授权给 Moderna,而不是当初限定的两个治疗领域,也不是由 Acuitas 开发并完成临床前验证的产品。
2018 年 2 月,裁定结果剥夺了 Acuitas 继续使用和二次授权 LNP 技术的权益,Moderna 可以庆幸的是虽然无法在其他领域使用 LNP 技术,之前获得授权的 4 个产品仍然保留了使用权,Moderna 将向 Arbutus 支付费用。
Moderna 申明现在使用的是公司内部研发的新型脂质体递送技术,但 Arbutus 表示根据 Moderna 所发表的文献、报告和专利分析提出,Moderna 很难在不依靠 Arbutus 专利的情况下,开发出有效的脂质体递送技术。因此,不能排除 Moderna 将继续陷入专利战的可能。
Moderna 的核苷修饰技术则是另一专利纠纷的焦点。
体外合成的mRNA具有较高的免疫原性,可能会诱发大量炎症反应。人体对 mRNA 的免疫反应主要和尿苷 (部分由尿嘧啶组成)有关,而利用假尿嘧啶替代尿嘧啶就能够减少免疫系统对 mRNA 的识别,这种修饰策略最初由宾夕法尼亚大学发明并最终将专利卖给了 Cellscript。
Moderna 在成立之初的重点之一,就是找到能够绕开假尿嘧啶专利的新的修饰方法,并且似乎是成功了——Moderna 找到了 1 - 甲基假尿嘧啶,并终于在 2014 年获得了多项专利授权。但令人玩味的是,2017 年 6 月,Moderna 仍然选择了从 Cellscipt 购买假尿嘧啶核苷修饰方法的专利使用权,并为此先期支付了 7500 万美元的专利使用费,以及后续每个产品 2600 万美元的里程碑付款和个位数的销售提成。Moderna 现在的产品线是否有专利护城河保卫,令人生疑。
生辉观点
mRNA 疫苗生产工艺简单、合成快速、成本较低,本身具有激活免疫反应的佐剂作用。Moderna、CureVac 等公司融资金额已经很高,但最快的临床试验仅进展到 II 期,由于动物环境和人体环境差异较大,递送系统在人体内效率、mRNA 稳定性等都需要大量临床实验予以进一步验证。
国内方面,依托于重大高校科研专利,斯微 (上海) 生物科技有限公司﹑艾博生物医药(杭州)有限公司﹑上海蓝鹊生物医药有限公司在新冠疫苗的研发方面取得重要进展,尽管尚未进入临床试验阶段,安全性和有效性有待确认。
当前,mRNA 疫苗的研究还集中于增强其稳定性、调节其免疫原性、发展新的传递技术、拓展更广的疾病治疗范围等方面,开发出成熟的药物仍有待时日。
参考
https://www.tandfonline.com/doi/full/10.4161/rna.22269
http://xueshu.baidu.com/usercenter/paper/show?paperid=e28268d4b63ddb3b22270ea1763b2892&site=xueshu_se
http://xueshu.baidu.com/usercenter/paper/show?paperid=e28268d4b63ddb3b22270ea1763b2892&site=xueshu_se
http://xueshu.baidu.com/usercenter/paper/show?paperid=a985458fdb64a87549d6f241ee836675
本文内容分享自知乎文章《mRNA疫苗的三道必答难题:递送、给药、专利》作者:DeepTech深科技


