《mRNA-LNP疫苗的结构与稳定性》文献解读系列六
文章来源:AVT发布时间:2021-09-06浏览次数:
LNP稳定性
除了mRNA 的完整性外,LNP 的稳定性对于 mRNA-LNP 疫苗的质量也至关重要。目前的mRNA疫苗没有披露关于LNP 稳定性测试的数据,但 Onpattro (patisaran) 的siRNA-LNP 制剂保存在2~8°C 之间时具有三年的有效期,同时该产品不能冷冻保存。
Onpattro 的LNP 系统的组成是:可电离的阳离子脂质DLin-MC3-DMA、DSPC、胆固醇、PEG2000-C-DMG(见表 1)(摩尔比 50:10:38.5:1.5),它们在组成上类似于 Comirnaty 和 mRNA-1273的LNP。在一项siRNA-LNPs 的研究中用类脂质306O 13代替DLin-MC3-DMA,样品水溶液在 2°C 、pH 7 的环境下下能稳定储存156 天,其粒径和siRNA包封率没有明显变化。Suzuki 等人的补充研究表明 siRNA-LNP 能在 4°C 环境下稳定储存1.5。总之,这些数据都表明是mRNA 的不稳定,而不是 LNP 的不稳定,导致了当前mRNA-LNP疫苗的储存条件严苛和保质期短。
Fan等人总结了脂质体和 LNP的稳定性及其质量属性。LNP 可以承受化学和物理不稳定性,化学不稳定性包括 LNP 中易水解和氧化的脂质的降解。脂质氧化可能发生在不饱和脂肪酸部分(Comirnaty 和 mRNA-1273 不存在该问题)和胆固醇,氧化可能是PEG2000 -DMG中PEG基团存在杂质导致的结果。除此之外,氧化性杂质也可能导致包封的mRNA 氧化。脂质例如 DSPC 和可电离的阳离子脂质中的羧酸酯键容易受温度和pH依赖性的水解的影响(图 6)。
LNP 稳定性的另一个关键因素是物理稳定性,主要有三种类型的物理不稳定性:包封的药物的聚集、融合和泄漏。 LNP 在储存和流通过程中容易发生 LNP 的聚集,所以为了增加稳定性,LNP 中通常添加PEG化脂质,LNP微粒表面的PEG 分子可防止LNP 聚集。
另一种类型的物理不稳定性主要由于mRNA 的泄漏,这主要影响包封产品的稳定性。值得注意的是,包封率通常 > 90%,并且尚未报道过在储存期间出现mRNA泄露(用RiboGreen监测)的情况。未包封的mRNA(“裸露的mRNA”)几乎不会被细胞摄取;而且它会迅速被降解,因此无法用于翻译。
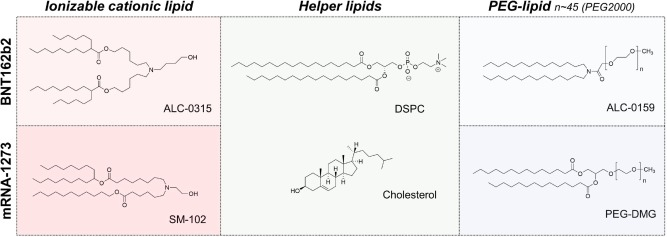
图6 用于 mRNA-LNP疫苗BNT162b2 (Comirnaty) 和 mRNA-1273的脂质。
由于注射 mRNA-LNP疫苗时的超敏反应可能与PEG化脂质有关,因此,已经研究了防止聚集体形成的替代脂质。使用多聚肌氨酸修饰脂质能使脂质递送系统更加稳定,在防止LNP聚集的同时能够减少超敏反应。但是目前仍然需要更多的实验来确定这种 PEG化脂质替代品是否能真正的提高 mRNA 的稳定性(例如不含过氧化物,注:目前使用的PEG脂质由于工艺原因,会有一定的过氧化物杂质,这会引起LNP中其他含有不饱和键的脂质和mRNA的氧化降解)。
分析 LNP 稳定性
Fan 等人在前面提到的文章中对监测 LNP 稳定性的分析方法进行了专业评估。我们推荐感兴趣的读者可以查看相关文献。
mRNA-LNP中哪个成分更不稳定?
迄今为止,已有几项研究考察了在储存期间稳定 mRNA 和稳定 LNP 的方法。然而,两者之中哪一个才是mRNA-LNP稳定性的瓶颈?当mRNA-LNP 制剂未冷冻时,是mRNA 降解?还是 LNP 降解导致稳定性问题?还是 mRNA 与 LNP 的组合?
与mRNA-LNP 系统相比,包封化学修饰且高度稳定的siRNA 分子(例如 Onpattro)的LNP系统具有更长的有效期。这表明当前的稳定性瓶颈不是 LNP,而是 mRNA。
迄今为止,公开资料还没有披露关于 mRNA-LNP 制剂中 mRNA 和 LNP 完整性的研究报告。在研究存储效果的少数研究中,例如 Zhang等人的研究,并没有考察长期储存的稳定性。因此,我们将首先研究裸露的mRNA的长期稳定性,但需要注意的是,这可能与包封在 LNP中的 mRNA 的稳定性有所不同(见下文)。
在Pascolo等人的综述中,裸露的mRNA的水溶液在无RNase的情况下只能在4°C下储存几天。这似乎符合目前对 mRNA 不稳定性的看法。目前关于裸露的mRNA长期稳定性的研究表明,mRNA 需要冷冻或干燥才能保持更长时间的稳定。
Roesler等人2009年的研究表明,编码荧光素酶的mRNA 在无RNA酶存在的条件下,分别以液体或冻干形式在室温下储存,表达效率分别在第8天和第16天开始出现降低,冻干辅料和冻干工艺方面未经优化(见图 7)。同时本研究无法得出关于2-8℃温度下长期储存稳定性的结论,因为稳定性研究只考察了32 天。
Wayment-Steele等人经过基于理论降解速率计算,预测 长度为4000 nt的mRNA在 pH 7.4 和5 °C 的条件下,存储的半衰期为 941 天。他们注意到较长的mRNA序列,例如SAM,更容易发生水解。由于这是jin基于水解降解动力学的理论计算结果,可能会低估 了mRNA的实际降解速率,例如,当存在痕量RNase时,必须对 mRNA 的稳定性进行更多研究才能知道mRNA实际存储的稳定性情况。
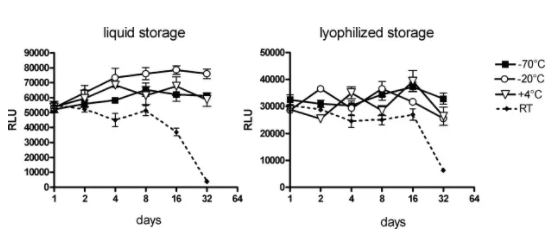
图7 通过转染BHK-21细胞中荧光素酶表达效率分析mRNA在水中的稳定性
这些研究表明,在水溶液中 mRNA 可能不如 LNP 稳定。然而,应该重申的是,这两种成分的稳定性考察结果可能与LNP包封mRNA 的情况不同。如前几节所述,mRNA 与可电离的阳离子脂质、胆固醇和水一起位于 LNP 核内部(参见图 4)。这意味着 mRNA 处于水性环境中,因此容易发生水解,其水解的机制可能与溶液中 mRNA水解 的机制相似。然而,另一方面,LNP 内的 mRNA 可能通过疏水、氢键和/或静电相互作用被可电离的脂质包裹。在这种情况下,mRNA 可能比溶解在水溶液中的裸露的mRNA更稳定。在没有进一步研究的情况下,只能得出结论,mRNA 的不稳定性导致了储存条件苛刻。
储存条件不同的原因
当前 mRNA 疫苗的另一个有趣方面是,不同厂家疫苗报告的储存温度和相应的“有效期”差异很大:从 -80°C 到 2-8°C,从几天到几个月。是否因为mRNA 疫苗处的不同导致这种储存条件的差异?又或者,储存条件的差异是否与热稳定性测试结果相关或更可靠的方法有关?这些信息很重要,因为深入了解对稳定性产生积极影响的因素可能是未来设计热稳定mRNA 疫苗的关键突破点。
Acuitas Therapeutics的首席执行官Tom Madden 曾经在采访中表示,Moderna 和 Pfizer/BioNTech mRNA 疫苗可能具有相同的稳定性。后者是否有可能使用更保守的方法来确保稳定性?尽管如此,目前必须在 -60 至 -80 °C 之间储存的Pfizer/BioNTech mRNA-LNP 疫苗很可能也在更高的温度和冷藏条件下进行了稳定性考察,正如CureVac 科学家所做的那样。
此外,稳定性测试中的分析技术在灵敏度上可能不同,验收标准也可能不同。疫苗稳定性研究报告的发布可能对这些疑问作出回答,对此进行比较研究会是很有趣的工作。
文献来源:
1. Abdelwahed, W., Degobert, G., Stainmesse, S., Fessi, H., 2006. Freeze-drying of
nanoparticles: Formulation, process and storage considerations. Adv. Drug Deliv.
Rev. 58 (15), 1688–1713. https://doi.org/10.1016/j.addr.2006.09.017.
2. Yanez Arteta, M., Kjellman, T., Bartesaghi, S., Wallin, S., Wu, X., Kvist, A.J.,
Dabkowska, A., Sz´ekely, N., Radulescu, A., Bergenholtz, J., Lindfors, L., 2018.
Successful reprogramming of cellular protein production through mRNA delivered
by functionalized lipid nanoparticles. Proc. Natl. Acad. Sci. U. S. A. 115 (15),
E3351–E3360. https://doi.org/10.1073/pnas.1720542115.
3. Ayat, N.R., Sun, Z., Sun, D.a., Yin, M., Hall, R.C., Vaidya, A.M., Liu, X., Schilb, A.L.,
Scheidt, J.H., Lu, Z.-R., 2019. Formulation of biocompatible targeted ECO/siRNA
nanoparticles with long-term stability for clinical translation of RNAi. Nucleic Acid
Ther. 29 (4), 195–207. https://doi.org/10.1089/nat.2019.0784.
4. Baden, L.R., El Sahly, H.M., Essink, B., Kotloff, K., Frey, S., Novak, R., Diemert, D.,
Spector, S.A., Rouphael, N., Creech, C.B., McGettigan, J., Khetan, S., Segall, N.,
Solis, J., Brosz, A., Fierro, C., Schwartz, H., Neuzil, K., Corey, L., Gilbert, P.,
Janes, H., Follmann, D., Marovich, M., Mascola, J., Polakowski, L., Ledgerwood, J.,
Graham, B.S., Bennett, H., Pajon, R., Knightly, C., Leav, B., Deng, W., Zhou, H.,
Han, S., Ivarsson, M., Miller, J., Zaks, T., 2021. Efficacy and safety of the mRNA-
1273 SARS-CoV-2 vaccine. N. Engl. J. Med. 384 (5), 403–416. https://doi.org/
10.1056/NEJMoa2035389.
5. Ball, R.L., Bajaj, P., Whitehead, K.A., 2016. Achieving long-term stability of lipid
nanoparticles: examining the effect of pH, temperature, and lyophilization. Int. J.
Nanomed. 12, 305–315. https://doi.org/10.2147/IJN.S123062.
6. Bloom, K., van den Berg, F., Arbuthnot, P., 2020. Self-amplifying RNA vaccines for
infectious diseases. Gene Ther. 1–13 https://doi.org/10.1038/s41434-020-00204-y.
Brader, M.L., Williams, S.J., Banks, J.M., Hui, W.H., Zhou, Z.H., Jin, L., 2021.
7. Encapsulation state of messenger RNA inside lipid nanoparticles. Biophys. J. https://
doi.org/10.1016/j.bpj.2021.03.012.
8. Brisco, M.J., Morley, A.A., 2012. Quantification of RNA integrity and its use for
measurement of transcript number. e144–e144 Nucleic Acids Res. 40. https://doi.
org/10.1093/nar/gks588.
9.Burke, P.A., Gindy, M.E., Mathre, D.J., Kumar, V., Prud’homme, R.K., 2013. Preparation
of Lipid Nanoparticles. US 2013/0037977.
10. Buschmann, M.D., Carrasco, M.J., Alishetty, S., Paige, M., Alameh, M.G., Weissman, D.,
2021. Nanomaterial delivery systems for mRNA vaccines. Vaccines 9 (1), 65. https://
doi.org/10.3390/vaccines9010065.


